|
|
|
我国第一批鼓励仿制药品目录发布 2019年最新医药行业相关政策汇总(表) |
作者: 来源:中商情报网 发布时间:2019-10-25 |
中商情报网讯:近日,国家卫健委发布了《第一批鼓励仿制药品目录》,共33种药品纳入鼓励仿制药。仿制药是指专利药品在专利保护期结束后,不拥有该专利的药企仿制的替代药品。仿制药与原研药具有相同的活性成分、剂型、给药途径和治疗作用。很多原研药价格昂贵,重症患者无力负担,价格便宜很多的仿制药成了他们的救命稻草。贫困患者迫切需要仿制药,但仿制药的供应和使用却遇到各种各样的障碍。仿制药在中国药品市场中扮演着日益重要的角色。中国医药工业信息中心测算得出,2016年中国仿制药市场规模约为9167亿元,受人口老龄化和医保控费等因素的影响,中国仿制药市场规模将持续增长。至2020年,其市场规模可能达到14116亿元。
为落实国务院办公厅《关于改革完善仿制药供应保障及使用政策的意见》和国家卫生健康委等12部门《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》有关制定鼓励仿制药品目录的部署和要求,国家卫生健康委联合科技部、工业和信息化部、国家药监局、国家知识产权局等部门组织专家对国内专利到期和专利即将到期尚没有提出注册申请、临床供应短缺(竞争不充分)以及企业主动申报的药品进行遴选论证,制定了《第一批鼓励仿制药品目录》。具体名单如下:
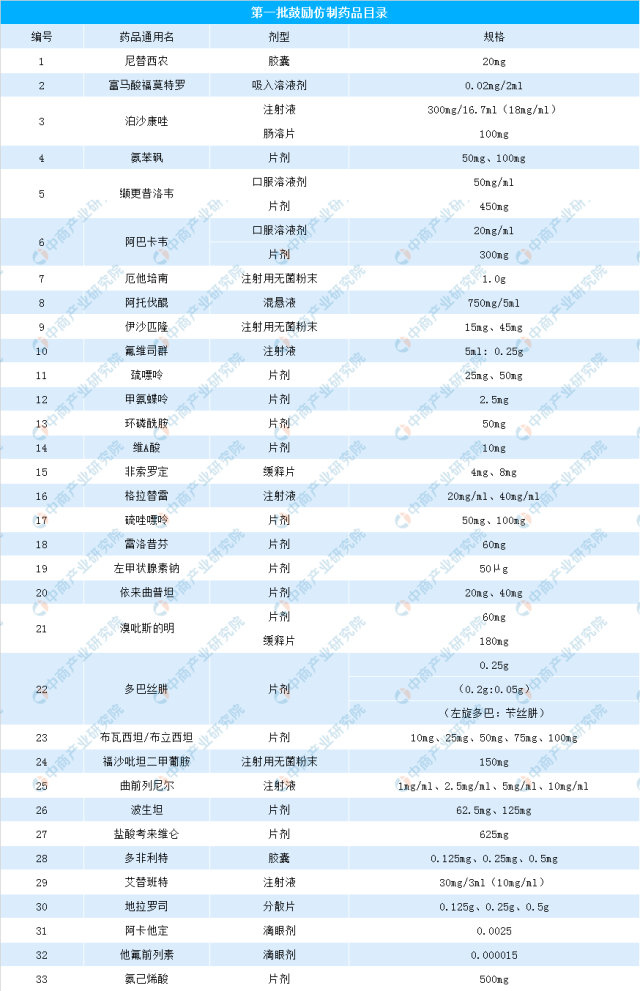 资料来源:卫健委、中商产业研究院整理
进入到2018年,中国医药行业步入新的发展阶段,仿制药通过国家一致性评价实现进口替代。
2018年4月,国务院《关于改革完善仿制药供应保障及使用政策的意见》的发布,无疑将对我国仿制药产业带来了指导性意见。《意见》明确了鼓励仿制药的药品范围:“临床必需、疗效确切、供应短缺”的药品。此外,鼓励仿制重大传染病防治和罕见病治疗所需药品、处置突发公共卫生事件所需药品、儿童使用药品以及专利到期前一年尚没有提出注册申请的药品。
另外,12月国家卫生健康委等12部门发布的《关于印发加快落实仿制药供应保障及使用政策工作方案的通知》,其中提出,要及时发布鼓励仿制的药品目录。根据临床用药需求,2019年6月底前,发布第一批鼓励仿制的药品目录,引导企业研发、注册和生产。2020年起,每年年底前发布鼓励仿制的药品目录。
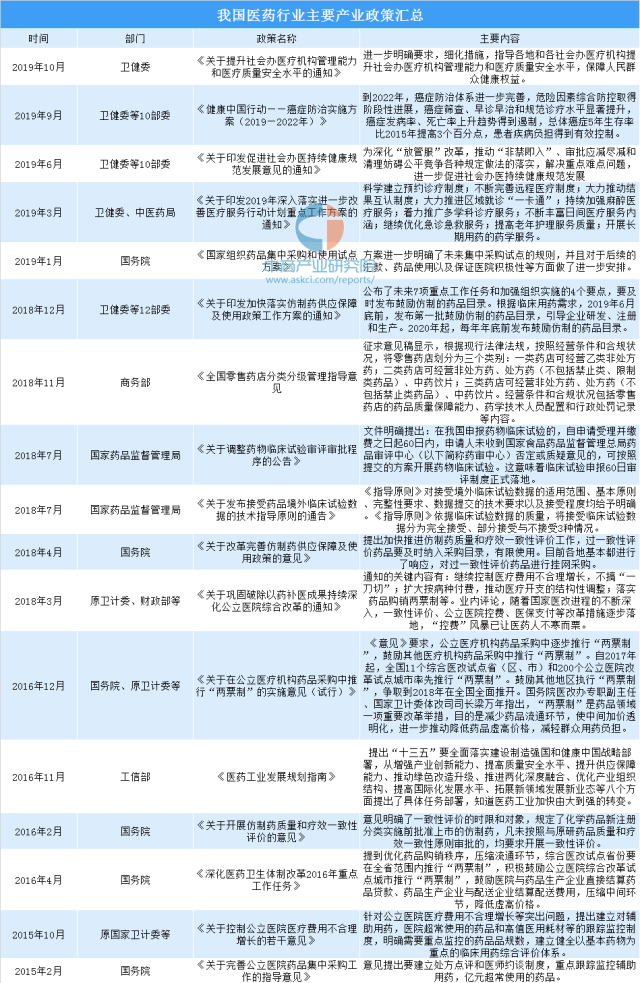 资料来源:中商产业研究院整理
|
|

