近日,CFDA起草了《化学药品注册分类改革工作方案(征求意见稿)》,与《药品注册管理办法》(2007版)相比,到底有哪些不同,有哪些看点?
2015年11月6日,为贯彻落实《国务院关于改革药品医疗器审评审批制度的意见》(国发〔2015〕44 号)提出的开展药品上市许可持有人制度试点工作及改革药品注册分类工作的相关要求,食品药品监管总局起草了《药品上市许可持有人制度试点方案(征求意见稿)》和《化学药品注册分类改革工作方案(征求意见稿)》。修改意见于2015年11月20日前通过电子邮件反馈至食品药品监管总局。
一,化药的定义改变确定
征求意见稿:根据药品的安全风险程度,将药品分为新药和仿制药两大类;其次,根据药品原创性和新颖性的不同,将新药进一步分为创新药和改良型新药;第三,在仿制药中,根据被仿制药上市情况不同,进一步细分为对境外上市、境内未上市药品的仿制,对境内上市药品的仿制以及境外上市药品申请境内上市三类。新药是指未在中国境内外上市销售的药品,将境外上市境内未上市药品纳入仿制药。
《药品注册管理办法》(2007版):药品注册申请包括新药申请、仿制药申请、进口药品申请及其补充申请和再注册申请。新药申请,是指未曾在中国境内上市销售的药品的注册申请。对已上市药品改变剂型、改变给药途径、增加新适应症的药品注册按照新药申请的程序申报。仿制药申请,是指生产国家食品药品监督管理局已批准上市的已有国家标准的药品的注册申请。
二、化药分类与新药监测期变化
化药分类方面,新增了“2.5类含有已知活性成份的新用法用量和新规格的制剂”。
新药监测期方面,2.4类“含有已知活性成份的新适应症的制剂”以往没有新药监测期,征求意见稿对新药监测期为3年,新增2.5类“含有已知活性成份的新用法用量和新规格的制剂”新药监测期也为3年。07年版《药品注册管理办法》中化学药品3.1类、3.2类和3.3类有相应的新药监测期,但是按照征求意见稿合并进新3类“仿制境外上市、境内未上市的药品”后并无新药监测期。
本次分类征求意见稿没有提及首仿药独占期。
表1 征求意见稿化学注册新分类和2007年版《药品注册管理办法》对比 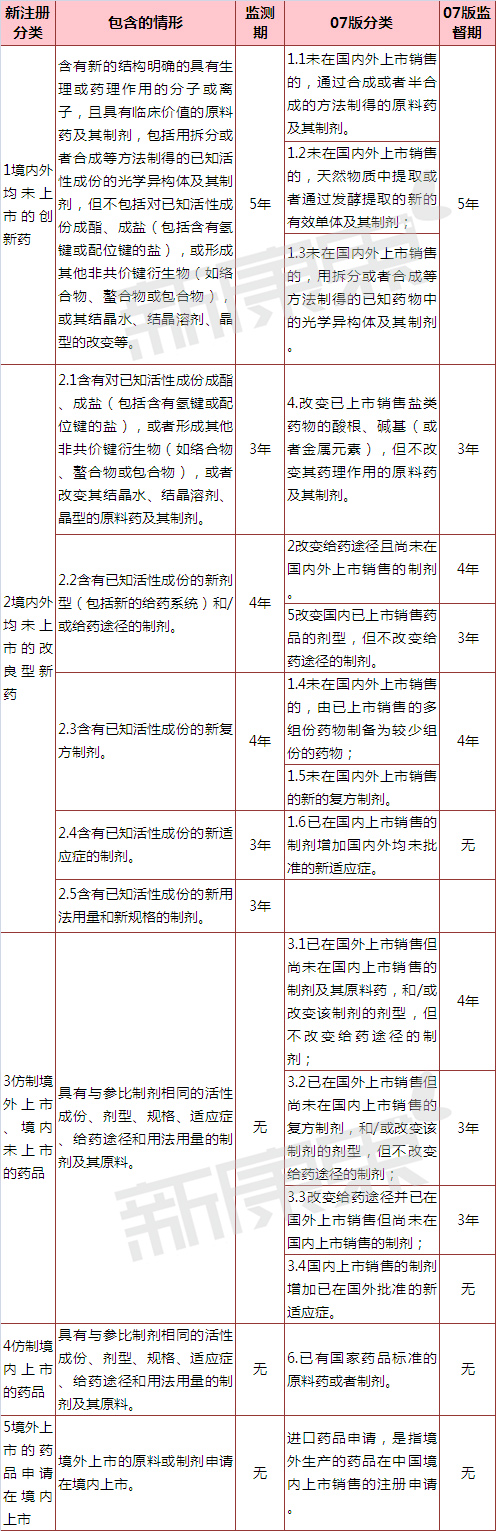 注:此分类对应只是个人初判,一切最终分类以国家局为准。
三、化学药品新注册分类申报资料更注重工艺
无论是创新药还是放制药,化学药品新注册分类申报资料对生产工艺、过程控制、物料控制、关键步骤和中间体的控制都有明确的要求,申报资料需包括详细的研究资料、实验数据及图谱,说明在开发阶段对哪些工艺步骤以何质量指标进行了工艺条件的优选与放大研究,以充分证明各步工艺均有充足的实验数据支持,保证现有的研究与生产的规模、物料控制、操作流程及主要设备均已基本与大生产一致,已生产的批数与各批产品的质量均能反映出工艺具备一定的重现性,进而证明该申报工艺的合理性与大生产的可行性。生产工艺表述的详略程度应能使本专业的技术人员根据申报的生产工艺可以完整地重复生产过程,并制得符合标准的产品。此外,还要求申报时提交工艺开发过程中生产工艺的主要变化(包括批量、设备、工艺参数以及工艺路线等的变化)的详细说明及相关的支持性验证研究资料。综上所述,申报资料的要求越来越接地气,能生产的才是王道。
申报资料还要求工艺评价要与稳定性试验和生物等效性试验结果进行相关分析,要求汇总研发过程中代表性批次(应包括但不限于临床研究批、中试放大批、生产现场检查批、工艺验证批等)的样品情况,包括:批号、生产时间及地点、批规模、用途(如用于稳定性试验,用于生物等效性试验等)、分析结果(例如有关物质、溶出度以及其他主要质量指标)。列表比较临床试验/BE试验样品的处方工艺、生产设备、批量、关键工艺步骤和工艺参数的控制、中间体的控制等与拟定的生产线的异同点,说明这些差异是否影响产品的质量,简要说明研究情况。
化学药药学申报资料还包括辅料申报资料要求和包装材料/容器申报资料要求,但本次征求意见稿并无一并公布,仍待注册司统一发布。 |

